Τις πρώτες πρωινές ώρες της 29ης Δεκεμβρίου, το NEJM δημοσίευσε στο διαδίκτυο μια νέα κλινική μελέτη φάσης III για τον νέο κινεζικό κορωνοϊό VV116. Τα αποτελέσματα έδειξαν ότι ο VV116 δεν ήταν χειρότερος από τον Paxlovid (νεματοβίρη/ριτοναβίρη) όσον αφορά τη διάρκεια της κλινικής ανάρρωσης και είχε λιγότερες ανεπιθύμητες ενέργειες.
Πηγή εικόνας: NEJM
Διάμεσος χρόνος ανάρρωσης 4 ημέρες, ποσοστό ανεπιθύμητων ενεργειών 67,4%
Το VV116 είναι ένα από του στόματος χορηγούμενο νουκλεοσιδικό φάρμακο κατά του νέου κορονοϊού (SARS-CoV-2) που αναπτύχθηκε σε συνεργασία με την Junsit και την Wang Shan Wang Shui και είναι ένας αναστολέας RdRp μαζί με τη ρεμδεσιβίρη της Gilead, τη μολουπιραβίρη της Merck Sharp & Dohme και την αζελβουδίνη της Real Biologics.
Το 2021, ολοκληρώθηκε στο Ουζμπεκιστάν μια κλινική δοκιμή φάσης II του VV116. Τα αποτελέσματα της μελέτης έδειξαν ότι η ομάδα VV116 θα μπορούσε να βελτιώσει καλύτερα τα κλινικά συμπτώματα και να μειώσει σημαντικά τον κίνδυνο εξέλιξης στην κρίσιμη μορφή και θανάτου σε σύγκριση με την ομάδα ελέγχου. Με βάση τα θετικά αποτελέσματα αυτής της δοκιμής, το VV116 έχει εγκριθεί στο Ουζμπεκιστάν για τη θεραπεία ασθενών με μέτρια έως σοβαρή COVID-19 και έχει γίνει το πρώτο νέο από του στόματος φάρμακο για τη στεφανιαία νόσο που έχει εγκριθεί για κυκλοφορία στο εξωτερικό στην Κίνα [1].
Αυτή η κλινική δοκιμή φάσης III[2] (NCT05341609), με επικεφαλής τον Καθηγητή Zhao Ren του Νοσοκομείου Shanghai Ruijin, τον Καθηγητή Gaoyuan του Νοσοκομείου Shanghai Renji και τον Ακαδημαϊκό Ning Guang του Νοσοκομείου Shanghai Ruijin, ολοκληρώθηκε κατά τη διάρκεια της επιδημίας που προκλήθηκε από την παραλλαγή Omicron (B.1.1.529) από τον Μάρτιο έως τον Μάιο στη Σαγκάη, με στόχο την αξιολόγηση της αποτελεσματικότητας και της ασφάλειας του VV116 έναντι του Paxlovid για την πρώιμη θεραπεία ασθενών με ήπια έως μέτρια COVID-19. Στόχος ήταν η αξιολόγηση της αποτελεσματικότητας και της ασφάλειας του VV116 έναντι του Paxlovid για την πρώιμη θεραπεία ασθενών με ήπια έως μέτρια COVID-19.
Πηγή εικόνας: Αναφορά 2
Μια πολυκεντρική, τυφλή ως προς τον παρατηρητή, τυχαιοποιημένη, ελεγχόμενη δοκιμή 822 ενήλικων ασθενών με Covid-19 με υψηλό κίνδυνο εξέλιξης και με ήπια έως μέτρια συμπτώματα διεξήχθη μεταξύ 4 Απριλίου και 2 Μαΐου 2022 για να αξιολογηθεί η επιλεξιμότητα των συμμετεχόντων από επτά νοσοκομεία στη Σαγκάη της Κίνας. Τελικά, 771 συμμετέχοντες έλαβαν είτε VV116 (384, 600 mg κάθε 12 ώρες την ημέρα 1 και 300 mg κάθε 12 ώρες τις ημέρες 2-5) είτε Paxovid (387, 300 mg νιματουβίρη + 100 mg ριτοναβίρη κάθε 12 ώρες για 5 ημέρες) ως από του στόματος φαρμακευτική αγωγή.
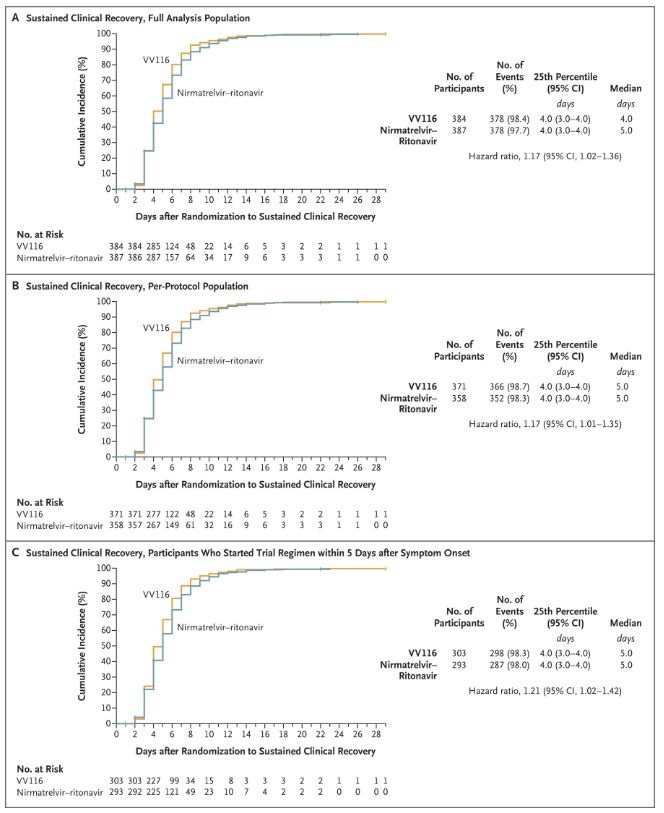
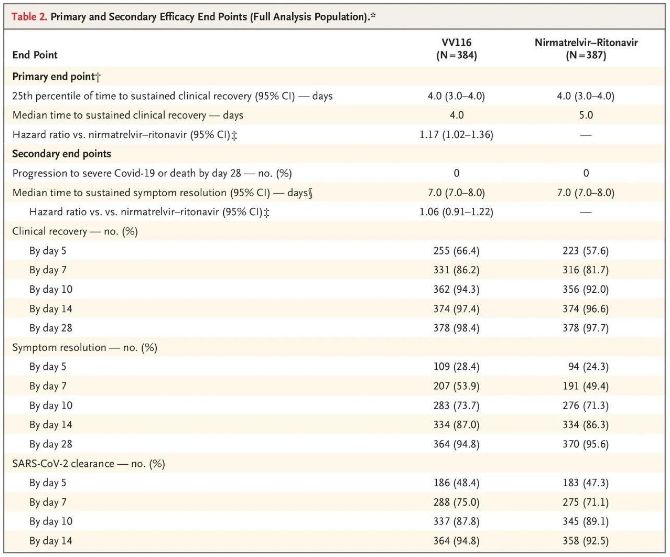
Τα αποτελέσματα αυτής της κλινικής μελέτης έδειξαν ότι η έγκαιρη θεραπεία με VV116 για ήπια έως μέτρια COVID-19 πέτυχε το πρωτεύον καταληκτικό σημείο (χρόνος έως τη διατηρήσιμη κλινική ανάρρωση) που προβλεπόταν από το κλινικό πρωτόκολλο: ο διάμεσος χρόνος έως την κλινική ανάρρωση ήταν 4 ημέρες στην ομάδα VV116 και 5 ημέρες στην ομάδα Paxlovid (λόγος κινδύνου, 1,17· 95% CI, 1,02 έως 1,36· κατώτερο όριο >0,8).
Διατήρηση του χρόνου κλινικής ανάρρωσης
Πρωτεύοντα και δευτερεύοντα τελικά σημεία αποτελεσματικότητας (ολοκληρωμένη ανάλυση του πληθυσμού)
Πηγή εικόνας: Αναφορά 2
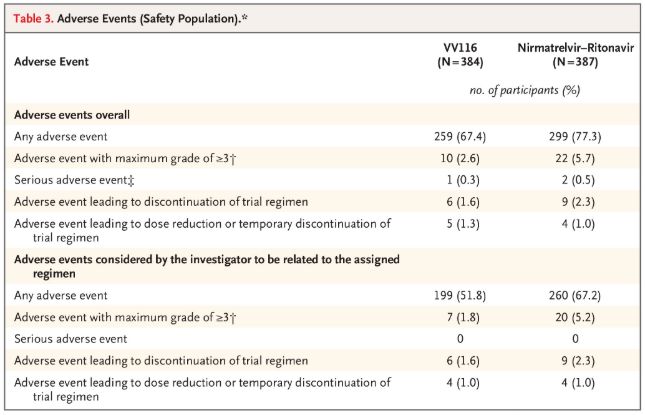
Όσον αφορά την ασφάλεια, οι συμμετέχοντες που έλαβαν VV116 ανέφεραν λιγότερες ανεπιθύμητες ενέργειες (67,4%) από εκείνους που έλαβαν Paxlovid (77,3%) κατά την 28ήμερη παρακολούθηση, και η συχνότητα εμφάνισης ανεπιθύμητων ενεργειών Βαθμού 3/4 ήταν χαμηλότερη για το VV116 (2,6%) από ό,τι για το Paxlovid (5,7%).
Ανεπιθύμητα συμβάντα (ασφαλή άτομα)
Πηγή εικόνας: Αναφορά 2
Αντιπαραθέσεις και ερωτήματα
Στις 23 Μαΐου 2022, η Juniper αποκάλυψε ότι η κλινική μελέτη Φάσης III για την καταχώριση του VV116 έναντι του PAXLOVID για την πρώιμη θεραπεία της ήπιας έως μέτριας COVID-19 (NCT05341609) πέτυχε το κύριο καταληκτικό σημείο της μελέτης.
Πηγή εικόνας: Αναφορά 1
Σε μια εποχή που οι λεπτομέρειες της κλινικής δοκιμής ήταν ελλιπείς, η διαμάχη γύρω από τη μελέτη Φάσης III ήταν διττή: πρώτον, ήταν μια μονοτυφλή μελέτη και, ελλείψει ελέγχου με εικονικό φάρμακο, υπήρχε ο φόβος ότι θα ήταν δύσκολο να κριθεί το φάρμακο πλήρως αντικειμενικά· δεύτερον, υπήρχαν ερωτήματα σχετικά με τα κλινικά τελικά σημεία.
Τα κλινικά κριτήρια ένταξης για την Juniper είναι (i) θετικά αποτελέσματα για το νέο τεστ κορώνας, (ii) ένα ή περισσότερα ήπια ή μέτρια συμπτώματα COVID-19 και (iii) ασθενείς με υψηλό κίνδυνο σοβαρής COVID-19, συμπεριλαμβανομένου του θανάτου. Ωστόσο, το μόνο πρωτεύον κλινικό καταληκτικό σημείο είναι ο «χρόνος έως τη διαρκή κλινική ανάρρωση».
Λίγο πριν από την ανακοίνωση, στις 14 Μαΐου, η Juniper είχε αναθεωρήσει τα κλινικά τελικά σημεία αφαιρώντας ένα από τα πρωτεύοντα κλινικά τελικά σημεία, το «ποσοστό των μετατροπών σε σοβαρή ασθένεια ή θάνατο» [3].
Πηγή εικόνας: Αναφορά 1
Αυτά τα δύο κύρια σημεία διαφωνίας εξετάστηκαν επίσης συγκεκριμένα στη δημοσιευμένη μελέτη.
Λόγω της ξαφνικής έξαρσης του Omicron, η παραγωγή δισκίων εικονικού φαρμάκου για το Paxlovid δεν είχε ολοκληρωθεί πριν από την έναρξη της δοκιμής και ως εκ τούτου οι ερευνητές δεν μπόρεσαν να διεξάγουν αυτήν τη δοκιμή χρησιμοποιώντας διπλά τυφλό, διπλά εικονικό σχεδιασμό. Όσον αφορά την μονοτυφλή πτυχή της κλινικής δοκιμής, η Juniper δήλωσε ότι το πρωτόκολλο διεξήχθη μετά από επικοινωνία με τις ρυθμιστικές αρχές και ότι ο μονοτυφλός σχεδιασμός σημαίνει ότι ούτε ο ερευνητής (συμπεριλαμβανομένου του αξιολογητή του τελικού σημείου της μελέτης) ούτε ο χορηγός θα γνωρίζουν την συγκεκριμένη κατανομή των θεραπευτικών φαρμάκων μέχρι να κλειδωθεί η τελική βάση δεδομένων στο τέλος της μελέτης.
Μέχρι τη στιγμή της τελικής ανάλυσης, κανένας από τους συμμετέχοντες στη δοκιμή δεν είχε πεθάνει ή δεν είχε επιδεινωθεί σε σοβαρό συμβάν Covid-19, επομένως δεν μπορούν να εξαχθούν συμπεράσματα σχετικά με την αποτελεσματικότητα του VV116 στην πρόληψη της εξέλιξης σε σοβαρό ή κρίσιμο Covid-19 ή θάνατο. Τα δεδομένα έδειξαν ότι ο εκτιμώμενος διάμεσος χρόνος από την τυχαιοποίηση έως τη διαρκή υποχώρηση των συμπτωμάτων-στόχων που σχετίζονται με την Covid-19 ήταν 7 ημέρες (95% ΔΕ, 7 έως 8) και στις δύο ομάδες (λόγος κινδύνου, 1,06; 95% ΔΕ, 0,91 έως 1,22) [2]. Δεν είναι δύσκολο να εξηγηθεί γιατί το κύριο τελικό σημείο του «ποσοστού μετατροπής σε σοβαρή ασθένεια ή θάνατο», το οποίο είχε αρχικά οριστεί πριν από το τέλος της δοκιμής, αφαιρέθηκε.
Στις 18 Μαΐου 2022, το περιοδικό Emerging Microbes & Infections δημοσίευσε τα αποτελέσματα της πρώτης κλινικής δοκιμής του VV116 σε ασθενείς που είχαν μολυνθεί με την παραλλαγή Omicron [4], μιας ανοιχτής, προοπτικής μελέτης κοόρτης με 136 επιβεβαιωμένους νοσηλευόμενους ασθενείς.
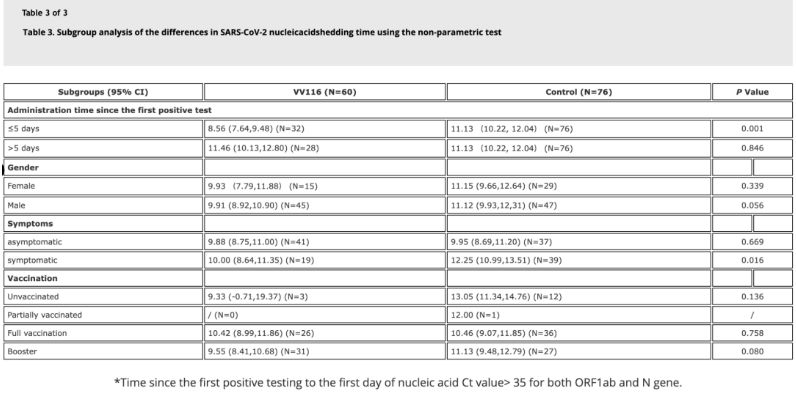
Τα δεδομένα από τη μελέτη έδειξαν ότι ασθενείς με λοίμωξη από το Όμικρον που χρησιμοποίησαν το VV116 εντός 5 ημερών από το πρώτο θετικό τεστ νουκλεϊκού οξέος είχαν χρόνο έως την υποχώρηση του νουκλεϊκού οξέος 8,56 ημερών, λιγότερο από τις 11,13 ημέρες στην ομάδα ελέγχου. Η χορήγηση του VV116 σε συμπτωματικούς ασθενείς εντός του χρονικού πλαισίου αυτής της μελέτης (2-10 ημέρες από το πρώτο θετικό τεστ νουκλεϊκού οξέος) μείωσε τον χρόνο έως την υποχώρηση του νουκλεϊκού οξέος σε όλους τους ασθενείς. Όσον αφορά την ασφάλεια του φαρμάκου, δεν παρατηρήθηκαν σοβαρές ανεπιθύμητες ενέργειες στην ομάδα θεραπείας με VV116.
Πηγή εικόνας: Αναφορά 4
Υπάρχουν τρεις κλινικές δοκιμές σε εξέλιξη για το VV116, δύο εκ των οποίων είναι μελέτες φάσης III για ήπια έως μέτρια COVID-19 (NCT05242042, NCT05582629). Η άλλη δοκιμή για μέτρια έως σοβαρή COVID-19 είναι μια διεθνής πολυκεντρική, τυχαιοποιημένη, διπλά τυφλή κλινική μελέτη φάσης III (NCT05279235) για την αξιολόγηση της αποτελεσματικότητας και της ασφάλειας του VV116 σε σύγκριση με την τυπική θεραπεία. Σύμφωνα με την ανακοίνωση της Juniper, ο πρώτος ασθενής εγγράφηκε και έλαβε τη δόση τον Μάρτιο του 2022.
Πηγή εικόνας: clinicaltrials.gov
Αναφορές:
[1]Junshi Biotech: Ανακοίνωση σχετικά με το κύριο τελικό σημείο της εγγεγραμμένης κλινικής μελέτης Φάσης III του VV116 έναντι του PAXLOVID για την πρώιμη θεραπεία της ήπιας έως μέτριας COVID-19
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] Ensi Ma, Jingwen, Zhingwen, Ai, Yinnogangi Xu, Hao Yin, Zhiren Fu, Hao Xing, Li Li, Liying Sun, Heyu Huang, Quanbao Zhang, Linlin Xu, Yanting Jin, Rui Chen, Guoyue Lv, Zhijun Zhu, Wenhong Zhang, Zhengxin Wang. (2022) Προφίλ λοιμώξεων Omicron και κατάσταση εμβολιασμού μεταξύ 1881 ληπτών μοσχευμάτων ήπατος: μια πολυκεντρική αναδρομική κοόρτη. Emerging Microbes & Infections 11:1, σελίδες 2636-2644.
Ώρα δημοσίευσης: 06 Ιανουαρίου 2023
 中文网站
中文网站